Se trata de una enfermedad de naturaleza degenerativa y pronóstico mortal que afecta aproximadamente a una persona por millón (prevalencia de 1:106) a nivel global. En Estados Unidos hay 127 pacientes de ECJ y sus variantes (2006).
De acuerdo con la evidencia disponible, la ECJ resulta del plegamiento anormal de un prión. Este fenómeno parece estimular a que otras proteínas alteren sus formas, afectando su capacidad para funcionar. Por esto, se la clasifica entre las enfermedades priónicas o encefalopatías espongiformes transmisibles (EET), caracterizadas por presentar una forma anómala de la proteína priónica celular (PrPC).
Estas enfermedades pueden existir en formas esporádicas (idiopáticas), hereditarias, y adquiridas। El término espongiforme alude al aspecto esponjoso que presenta en la autopsia el cerebro afectado.
eneralidades
La ECJ aparece generalmente en la edad madura y evoluciona con rapidez, afectando en proporciones comparables a hombres y mujeres.[1] Típicamente, los síntomas comienzan aproximadamente a la edad de 60 años y un 90% de los pacientes muere al cabo de un año. En las etapas iniciales de la enfermedad, los enfermos sufren fallos de memoria, cambios de comportamiento, falta de coordinación y perturbaciones visuales. A medida que progresa, el deterioro mental se hace más pronunciado y pueden darse movimientos involuntarios, ceguera, debilidad de las extremidades y coma, culminando sin excepción con la muerte del paciente.
El responsable de la ECJ es un prión, partícula infecciosa constituida por una sola molécula de proteína, que no contiene ácidos nucleicos ni información genética, muy difícil de destruir e inmune a los mecanismos de esterilización tradicionales.
[editar] Descripción clásica
Aunque es posible que la enfermedad se conociera desde la más remota antigüedad, sus síntomas inespecíficos deben haber sido confundidos con otros tipos de demencia durante siglos. Esta enfermedad fue descrita por primera vez por los neurólogos alemanes Hans-Gerhard Creutzfeldt y Alfons Maria Jakob en 1920.
Algunos de los hallazgos clínicos que ellos describieron en sus primeros documentos sobre la ECJ no se corresponden con los criterios actuales sobre la misma, por lo que se considera altamente probable que algunos de los casos estudiados (por lo menos dos) en sus investigaciones iniciales fueran víctimas de otra enfermedad.
Los primeros síntomas de la enfermedad de Creutzfeldt-Jakob incluyen típicamente demencia — cambios de personalidad junto con deterioro de la memoria, el juicio y el pensamiento— y problemas de coordinación muscular. Las personas con la enfermedad también pueden experimentar insomnio, depresión o sensaciones inusitadas. La ECJ no ocasiona fiebre ni otros síntomas comunes.
A medida que progresa la enfermedad, el deterioro mental del paciente se agudiza. A menudo comienza a tener contracciones musculares involuntarias llamadas mioclono y puede quedar ciego, perder el control de los esfínteres o una amplia variedad de otros graves síntomas neurológicos. Con el tiempo los enfermos ya no pueden moverse ni hablar y caen en coma. La neumonía y otras infecciones complican a menudo el curso de la enfermedad y pueden conducir a la muerte por sí mismas.
[editar] La nueva variante
Alrededor de 1920 se describieron algunos casos que probablemente fueran en realidad de ECJ adquirida, aunque muchos investigadores opinan que se trataba de otra enfermedad priónica denominada kuru, que se transmitía entre los nativos de la etnia fore de Nueva Guinea debido a los ritos funerarios de canibalismo familiar.
En 1996, se reportó en el Reino Unido la "nueva variante" de ECJ (ECJv),[2] y se describieron diez casos ocurridos entre 1994 y 1995.[3] La nueva variante se puede transmitir por contagio entre distintas especies y, posiblemente, de persona a persona. Actualmente se postula que, en algunos casos, la forma adquirida de la ECJ sería la patología humana subsiguiente a la infección con el llamado "mal de la vaca loca", nombre con que se conoce la encefalopatía espongiforme bovina (EEB). No obstante, cabe aclarar que en el último caso, tanto la leche, como el músculo, el tejido adiposo y los fluidos (saliva, sangre, orina, semen) del ganado bovino carecen de capacidad infectiva por vía oral.[4]
Desde 1995 y hasta la mitad del año 2008 se han registrado 204 casos de este tipo,[5] ocurridos mayoritariamente en Gran Bretaña.
[editar] Diagnóstico
El diagnóstico correcto de la ECJ es muy difícil, porque a menudo los síntomas pueden confundirse con los de otros trastornos neurológicos progresivos tales como el Alzheimer o la enfermedad de Huntington. Sin embargo, la ECJ ocasiona inconfundibles cambios en el tejido cerebral, claramente visibles en la autopsia. También tiende a ocasionar un deterioro más rápido de las capacidades del paciente que la enfermedad de Alzheimer o la mayoría de los demás tipos de demencia.
En la actualidad no hay una prueba diagnóstica certera para la enfermedad de Creutzfeldt-Jakob. Cuando un médico sospecha la presencia de ECJ, la primera preocupación consiste en descartar otras formas tratables de demencia tales como la encefalitis (inflamación del cerebro) o la meningitis crónica, por lo que se requiere la evaluación por un neurólogo cualificado. Las pruebas estándar de diagnóstico incluyen una punción espinal para descartar otras causas de demencia y un electroencefalograma (EEG) para registrar el patrón eléctrico del cerebro, que puede ser particularmente valioso ya que muestra un tipo específico de anomalía en la ECJ.[1] La tomografía computarizada de cerebro puede ayudar a descartar la posibilidad de que los síntomas sean el resultado de otros problemas tales como un ataque al corazón o un tumor cerebral. Las exploraciones del cerebro mediante imágenes de resonancia magnética nuclear (RMN) también pueden poner de relieve patrones característicos de degeneración cerebral que ayuden a diagnosticar la ECJ.
La única forma de confirmar un diagnóstico de la ECJ es mediante una biopsia o autopsia cerebral. En una biopsia cerebral, el neurocirujano separa un pequeño trozo de tejido del cerebro del paciente a fin de que pueda examinarlo un neuropatólogo. Este procedimiento puede ser peligroso para el paciente y la operación no siempre obtiene el tejido de la parte afectada del cerebro. Debido a que un diagnóstico correcto de la ECJ no mejora el pronóstico ni las posibilidades de tratamiento, la biopsia cerebral no se aconseja a menos que se necesite para descartar un trastorno tratable. En una autopsia, se examina todo el cerebro después de la muerte.
Hay tres clases principales de la enfermedad de Creutzfeldt-Jakob (ECJ).
[editar] ECJ esporádica
En estos casos, la enfermedad se presenta aun cuando la persona parece estar libre de factores de riesgo asociados, es decir, la etiología es desconocida. Su alcance es mundial, siendo ocasionada a veces por una mutación sin sentido del gen de la proteína priónica (PRNP). Otras veces, el envejecimiento es el único factor de riesgo consistente.[4] Asimismo, se han identificado otras mutaciones que no causan directamente la enfermedad pero vuelven a los individuos más susceptibles de contraer la infección con el prión. Estas últimas mutaciones estarían implicadas parcialmente en la incidencia esporádica de la enfermedad.
Este es el tipo más común de ECJ, manifestándose en, al menos, un 85% de los casos. Sin embargo, no es posible adscribir directamente los casos de ECJ esporádica a los otros dos grupos. La revisión de los hallazgos clínicos en casos de ECJv reveló que éstos diferían sustancialmente de los tradicionalmente observados en casos esporádicos.[6]
- Forma panencefalopática
- La enfermedad de Creutzfeldt-Jakob forma panencefalopática (ECJfp) ocurre principalmente en el Japón y tiene un curso relativamente largo, con síntomas que progresan a menudo por varios años. Como su nombre lo indica, no afecta solamente al cerebro sino a todo el encéfalo.
[editar] ECJ hereditaria
Se puede determinar en la historia del paciente algún antecedente familiar de la enfermedad o pruebas positivas de mutación genética asociada con el gen productor del prión causante de la ECJ. En los Estados Unidos de América, entre el 5 y el 10% de los casos de ECJ son de origen genético y hereditario. En 1950, se reportó y se realizó el seguimiento del primer caso familiar con miembros de tres generaciones probablemente afectados.[7] Asimismo, está documentada la transmisión de varón a varón. En 1979, se estableció que cerca de un 15% de los casos de ECJ son de tipo familiar.[8] En 1981, otro estudio sobre 73 familias determinó un historial consistente con un patrón de herencia autosómica dominante.[9] El fenotipo clínico es semejante al observado en el ECJ esporádico, aunque esta forma suele presentarse a edades más tempranas.[4]
[editar] ECJ adquirida
La enfermedad es transmitida por exposición directa al prión, mediante contacto con tejidos cerebrales o del sistema nervioso infectados. Se ha probado el contagio mediante ciertos procedimientos médicos, estando también expuestos los veterinarios que han tenido contacto con vacas u ovinos enfermos, personal de la industria de la carne, etc. Sin embargo, no hay pruebas de que la ECJ pueda contagiarse mediante un contacto casual con los enfermos. Desde que la ECJ se describiera por primera vez, menos de 1% de los casos se han probado como adquiridos más allá de toda duda.
Si bien la ECJ puede transmitirse de persona a persona, el riesgo de que esto ocurra es sumamente bajo. La ECJ no parece poder transmitirse a través del aire o al tocar a otra persona o mediante la mayoría de las formas de contacto casual. Los cónyuges y otros miembros de la familia de pacientes con ECJ esporádica no están sometidos a un riesgo mayor de contraer la enfermedad que la población en general (excepto en los casos obviamente hereditarios respecto de los hijos y otros descendientes).
- Forma iatrogénica
- El contacto directo o indirecto con el tejido cerebral y el líquido de la médula espinal de los pacientes infectados debe evitarse para impedir la transmisión de la enfermedad a través de estos materiales. En unos cuantos casos muy raros pero perfectamente demostrados, la ECJ se ha propagado a otras personas a raíz de injertos de duramadre (una de las meninges, tejidos que cubren el cerebro), córneas trasplantadas, implantación de electrodos inadecuadamente esterilizados en el cerebro e inyecciones de hormona somatotropa contaminada obtenida de glándulas pituitarias humanas tomadas de cadáveres.[10] [11] Los médicos llaman a estos casos —provocados por procedimientos médicos— "casos iatrogénicos".
- Nueva variante
- La enfermedad de Creutzfeldt-Jakob variante o nueva variante (ECJv o ECJnv) fue descrita en el Reino Unido y en Francia, y comienza principalmente con síntomas psiquiátricos. Afecta a pacientes más jóvenes que los de otros tipos de ECJ y tiene una duración más larga de lo ordinario desde el comienzo de los síntomas hasta la muerte. Fue descubierta en 1996 y es el tipo más relacionado con la exposición al prión responsable del mal de la vaca loca. Se cree que la ECJv es adquirida a partir del ganado infectado con EEB.[12]
[editar] Biología molecular

En un principio, se creyó que en el origen de la ECJ y otras EET existía un "virus lento" (Lentivirus) u otro organismo desconocido. Sin embargo, estos nunca han podido ser aislados. Además, el agente que ocasiona la ECJ tiene varias características que son raras en microorganismos tales como los virus y las bacterias. Es inmune a todos los métodos comunes de esterilización, no contiene ninguna información genética en forma de ácidos nucleicos (ADN o ARN) y presenta generalmente un largo periodo de incubación antes de que aparezcan los síntomas. En algunos casos, este lapso puede ser de hasta 40 años. La teoría científica principal —demostrada en la actualidad para el kuru, la EEB y los casos adquiridos de ECJ— afirma que estas EET no son ocasionadas por un microorganismo sino por un tipo de proteína llamado prión.
Los priones se presentan en forma normal como una proteína inocua hallada en las células del cuerpo, que controla ciertos aspectos de la vida celular. Sin embargo, el prión puede tomar también una forma infecciosa capaz de ocasionar la enfermedad. Este es el motivo de que el sistema inmune no sea capaz de luchar contra el prión, ya que se trata de una proteína propia, cuya presencia es normal en todas las células del cuerpo.
Las formas inocuas e infecciosas de la proteína y el prión son casi idénticas, pero la forma infecciosa adquiere una configuración plegada diferente a la de la proteína normal.
En la ECJ adquirida, el prión ingresa al organismo a través del contacto con priones infecciosos. En la ECJ hereditaria, el gen responsable de producir la proteína normal ha sufrido una mutación tal que sólo es capaz de producir la proteína patológica. Acaso la causa de la inexplicable forma esporádica sea que los priones normales se transforman —por razones aún desconocidas— en la versión infecciosa de la proteína.
La característica más letal de estos priones patológicos es que aunque haya uno solo de ellos, esta única molécula es capaz de "reconfigurar" a sus similares normales, produciendo una especie de imparable reacción en cadena que deja al organismo sin moléculas "sanas".
Una vez que aparecen, las proteínas de los priones anormales se unen y forman fibras o acumulaciones llamadas "placas amiloides", que pueden verse al microscopio. Las fibras y las placas pueden comenzar a depositarse años antes de que empiecen a aparecer los síntomas de las ECJ. Todavía no está claro el papel que desempeñan estas estructuras en la enfermedad o cómo pudieran afectar a los síntomas.
En las EET hereditarias, se han identificado varias (hasta 20) mutaciones diferentes en el gen de los priones. La mutación específica que se encuentra en cada familia afecta posiblemente al tipo de EET que experimentará, a la frecuencia con que aparece la enfermedad en la familia y al tipo de síntomas más notables. Sin embargo, no todas las personas con mutaciones en el gen de los priones adquieren la ECJ. Esto indica que las mutaciones pueden meramente aumentar la susceptibilidad a la ECJ y que tal vez existan otros factores aún desconocidos que también desempeñan un papel en la enfermedad, sin descartar el contagio por diversas vías.
[editar] Genética
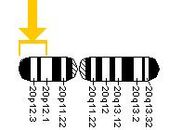
El gen productor del prión ha sido bautizado PRNP (Prion-Related Protein). Este gen se encuentra localizado en el brazo corto (p) del cromosoma 20, en la posición 20pter-p12 (es decir, entre la posición 20p12 y el final o término del brazo), ocupando 15.000 pares de bases: más precisamente, desde el par 4.615.068 al 4.630.233 del cromosoma. La proteína codificada por este gen se denomina PrPC (c por "celular", ya que se halla presente en todas las células). Sin embargo, una mutación en un único punto de este gen puede producir una forma patológica de la misma proteína, que ha sido llamada PrPSc (por scrapie, nombre inglés de la tembladera ovina o caprina —ICTVdb 90.001.0.01.001).
El reemplazo de una molécula del aminoácido lisina por prolina en uno de los sectores del gen PRNP hace que un grupo de 8 aminoácidos (octapéptido) comience a replicarse (copiarse a sí mismo), yendo cada nueva copia a cambiar a otras moléculas de PrPC en PrPSc. De este modo se explica la capacidad del prión para convertir moléculas normales en priones a su vez.
En 1995 se demostró que el error en este único aminoácido altera radicalmente toda la enorme estructura del resto de la proteína, reconfigurándola en una nueva forma denominada prión.
[editar] Cinética molecular del prión
Al encontrarse una molécula de PrPsc con una normal, la "moldea" o repliega en una forma diferente a la que tenía, reemplazando el aminoácido necesario para convertirla en una como ella. Esta va a transformar a otras, y así sucesivamente. Este proceso es particularmente fácil y eficiente en las neuronas. Parte de los túneles y vacuolas que dan al cerebro enfermo su característico aspecto de esponja son el resultado del "estallido" de neuronas infectadas que han liberado miles de priones en el medio intercelular.
Las teorías actuales afirman que las células nerviosas poseen un receptor químico en su membrana que se comporta a manera de "cerradura". Ciertas proteínas "asesinas", encargadas de aniquilar a las neuronas enfermas o anormales, introducen parte de su estructura en estos receptores a modo de "llave". El receptor de las células sanas está obstruido por una molécula de PrPc (es decir, normal), de forma que las proteínas asesinas no puedan reconocerla. Si el orificio está libre, la proteína asesina mata a la célula en cuestión.
Sin embargo, el prión, con su estructura deformada, no puede ocupar el sitio que le corresponde en la membrana, como una llave equivocada no puede introducirse en una cerradura ajena. La célula normal, pues, presenta el receptor libre, dando a la proteína asesina la impresión de que se trata de una que debe morir. En la ECJ y las demás EET, las proteínas asesinas matan a las neuronas normales confundiéndolas con células marcadas para ser destruidas.
[editar] Enfermedades relacionadas
| EET o enfermedades por priones en animales[4] |
|---|
| |
| Enfermedad esporádica, posiblemente genética e infecciosa |
| Scrapie (inglés), tremblante (francés),
tembladera, modorra o rascadera (español) Cabras, ovejas, carneros |
| Enfermedad infecciosa, posiblemente esporádica |
| EE bovina o "vacas locas" (vacas y toros) |
| EE felina (gatos en libertad y cautivos) |
| Encefalopatía transmisible del visón, del ciervo y antílopes |
| EE de rumiantes de zoo y ungulados |
| EE en diversos animales de experimentación |
| Enfermedad genética |
| EE de ratón transgénico |
Existen varias otras enfermedades humanas relacionadas con la ECJ, todas ellas producidas por priones similares:
- Kuru: primera enfermedad priónica identificada en el ser humano, al principio se la confundió con una patología virósica. Era común en una tribu aislada de Nueva Guinea, entre cuyos habitantes se acostumbraba comer los cerebros de los familiares muertos. Fue descubierta alrededor de 1900, y, gracias a que los nativos fueron disuadidos de sus extraños hábitos, hoy se la considera extinta.
- Enfermedad de Gerstmann-Straussler-Scheinker (GSS): se trata de un mal rarísimo, que sólo afecta a un puñado de familias en todo el mundo. Por este motivo, se considera casi segura la herencia del gen responsable de producir el prión. De síntomas similares a la ECJ, su desarrollo es más lento (cursa entre 2 a 10 años). Es también fatal e incurable.
- Insomnio familiar fatal (IFF): producido por una mutación diferente del gen del prión de la ECJ, es extremadamente raro y sus pocos casos registrados se han observado en España.
- Otras enfermedades priónicas: la variedad de sintomatologías clínicas en las enfermedades priónicas ha llevado a la definición clínica de otras patologías del mismo grupo (incluyendo numerosos casos de Alzheimer que han sido reexaminados y hoy se cuentan entre las EET):
- Demencia por prión sin patología característica
- Demencia con paraparesia espástica
- Demencia talámica
- Encefalopatía espongiforme familiar asociada a una nueva mutación en el gen PrP
- Gliosis subcortical progresiva
- Enfermedad mental sin signos neurológicos
- Enfermedad de Alzheimer familiar producida por priones
Asimismo, se conocen numerosas variantes que afectan a distintas especies animales: équidos, bovinos, ovinos, caprinos, felinos, mustélidos y ungulados exóticos.
[editar] Tratamiento
No existe actualmente (año 2010) tratamiento que pueda curar, mejorar ni siquiera controlar la sintomatología en la enfermedad de Creutzfeldt-Jakob. Los investigadores han sometido a prueba muchos fármacos, entre ellos la amantadina, los esteroides, el interferón, el aciclovir, la clorpromazina,[13] y diversos agentes antivirales y antibióticos. No obstante, ninguno de estos tratamientos ha demostrado ser beneficioso.
El único tratamiento posible de la ECJ tiene como propósito principal aliviar los síntomas hasta donde sea posible y mejorar la calidad de vida del paciente. Las drogas opiáceas pueden ayudar a reducir el dolor si se presenta, y el clonazepam y el valproato de sodio pueden ayudar a paliar el mioclono. Durante las últimas etapas de la enfermedad, cambiar de posición al paciente ayuda a evitar lesiones y escaras, propias de la postración en cama. Puede emplearse un catéter para drenar la orina si el paciente no puede controlar la función de la vejiga y también puede utilizarse alimentación artificial, incluyendo líquidos intravenosos.
[editar] Investigación
Muchos investigadores están estudiando la ECJ, tratando de descubrir los factores que influyen en la infectividad de los priones. Utilizando modelos de roedores con la enfermedad y tejido cerebral de autopsias, también están intentando identificar aquellos factores que influyen en la susceptibilidad a la enfermedad y los que gobiernan el curso de la misma cuando aparece. los estudios para confirmar el diagnostico son de muy alto costo y solo los países con tecnología de punta pueden realizarlos, así que aun es más difícil hacer el diagnostico.
Esperan utilizar estos conocimientos para formular mejores pruebas diagnósticas y aprender el mecanismo íntimo por el que el prión mata a las neuronas a fin de que puedan formularse tratamientos eficaces.
[editar] El problema de las transfusiones de sangre
Un informe científico publicado en la prestigiosa revista británica The Lancet[14] ha demostrado que la ECJv puede transmitirse a través de las transfusiones de sangre. El descubrimiento alarmó a los sistemas de salud, porque es posible que una gran epidemia de la enfermedad aparezca en el futuro cercano.
No existe una prueba que permita determinar si la sangre donada está o no infectada con el prión. Aunque el donante no presente síntomas, puede hallarse en la fase latente de la enfermedad y transmitirla mediante la sangre donada.
Como reacción a este informe, el gobierno británico prohibió donar sangre a todos aquellos que hayan recibido una transfusión de sangre en fecha posterior a enero de 1980.
El 28 de mayo de 2002 la Administración de Drogas y Alimentos de los Estados Unidos (FDA), prohibió a su vez donar sangre a las personas que hayan vivido en las zonas de Europa consideradas de alto riesgo de EEB o ECJ entre 1980 y mediados de los 90. Dado el gran número de militares norteamericanos residentes en Europa, se cree que más del 7% de los mismos se verán impedidos de donar sangre en cumplimiento de esta norma.
Medidas similares fueron adoptadas por la Cruz Roja Australiana, que no permite donar a quienes hayan vivido un tiempo (acumulado) de al menos seis meses en el Reino Unido entre 1980 y 1996.
Canadá ha prohibido la donación de sangre a las personas que hayan vivido seis meses o más en el Reino Unido desde 1980. Lo mismo se aplica a quienes hayan residido en Francia por más de seis meses.
[editar] Víctimas famosas
La prensa masiva comenzó a ocuparse de la ECJ cuando falleció víctima de la misma el célebre coreógrafo ruso-norteamericano George Balanchine, a quien se considera la primera víctima famosa de este mal.
El artista nacido en San Petersburgo comenzó experimentando extraños problemas de equilibrio mientras danzaba en 1978. Después de perder la vista y el oído, quedó completamente incapacitado hacia 1982. Posteriormente desarrolló angina y un grave ataque cardíaco que obligó a practicarle una cirugía de bypass.
Ciego, sordo y paralítico, falleció el 30 de abril de 1983. La autopsia de su cerebro demostró claramente que había muerto de Creutzfeldt-aजाकोब
ATT=CESAR ALFONSO CHAPARRO


Como investigación esta muy bien, lo que sucede es que debemos documentarnos y luego elaborar el trabajo digitado y extractado para no pegar tanto texto, ahí esta el valor de este personalizado , demas Cristian excelente su aporte, muy valido
ResponderEliminarMi nombre es Hoover, mi hija de 18 años, Tricia, fue diagnosticada de herpes hace 3 años. Desde entonces, hemos estado yendo de un hospital a otro. Probamos todo tipo de píldoras, pero todos los esfuerzos para deshacernos del virus fueron inútiles. Las ampollas siguieron reapareciendo después de algunos meses. Mi hija estaba usando tabletas de 200 mg de aciclovir. 2 tabletas cada 6 horas y crema de fusitina 15 gramos. y H5 POT. Permanganato con agua para aplicar 2 veces al día, pero todos aún no muestran resultados. Así que estuve en Internet hace unos meses, buscando cualquier otro medio para salvar a mi único hijo. justo entonces, me encontré con un comentario sobre el tratamiento a base de hierbas dr imoloa y decidí probarlo. Me puse en contacto con él y él preparó algunas hierbas y me lo envió junto con pautas sobre cómo usar las hierbas a través del servicio de mensajería de DHL. mi hija lo usó según las indicaciones del Dr. imoloa y en menos de 14 días, mi hija recuperó su salud. Debe comunicarse con el Dr. imoloa hoy directamente en su dirección de correo electrónico para cualquier tipo de desafío de salud; enfermedad de lupus, úlcera bucal, cáncer de boca, dolor corporal, fiebre, hepatitis ABC, sífilis, diarrea, VIH / SIDA, enfermedad de Huntington, acné de espalda, insuficiencia renal crónica, enfermedad de addison, dolor crónico, enfermedad de Crohn, fibrosis quística, fibromialgia, inflamatorio Enfermedad intestinal, enfermedad fúngica de las uñas, enfermedad de Lyme, enfermedad de Celia, linfoma, depresión mayor, melanoma maligno, manía, melorostostis, enfermedad de Meniere, mucopolisacaridosis, esclerosis múltiple, distrofia muscular, artritis reumatoide, enfermedad de Alzheimer, enfermedad de Parkison, cáncer vaginal, epilepsia, Trastornos de ansiedad, enfermedad autoinmune, dolor de espalda, esguince de espalda, trastorno bipolar, tumor cerebral, maligno, bruxismo, bulimia, enfermedad del disco cervical, enfermedad cardiovascular, neoplasias, enfermedad respiratoria crónica, trastorno mental y conductual, fibrosis quística, hipertensión, diabetes, asma , Mediat autoinmune inflamatorio artritis ed. enfermedad renal crónica, enfermedad inflamatoria de las articulaciones, impotencia, espectro de alcohol feta, trastorno distímico, eccema, tuberculosis, síndrome de fatiga crónica, estreñimiento, enfermedad inflamatoria intestinal. y muchos más; comuníquese con él por correo electrónico: drimolaherbalmademedicine@gmail.com./ también por whatssap- + 2347081986098.
ResponderEliminar